Vous êtes ici
Kalydeco® disponible pour les très jeunes patients, âgés de 2 ans et plus : c’est officiel !
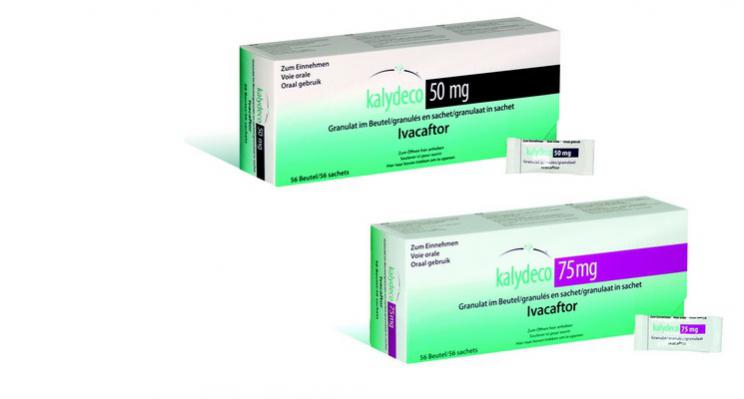
La parution au Journal Officiel du 1er mars 2017 rend Kalydeco® disponible pour les patients de 2 ans et plus, pesant moins de 25 kg, porteurs d’une mutation gating1.
Kalydeco® (ivacaftor), premier médicament ciblant les causes de la mucoviscidose, était jusqu'à présent prescrit aux patients, porteurs d’une mutation gating1 et âgés de 6 ans et plus. L’efficacité de ce médicament, administré en comprimé, a été démontrée sur les symptômes respiratoires, le poids, ainsi que la qualité de vie, qui s’améliorent de façon significative.
La parution au Journal Officiel du 1er mars 2017 rend ce traitement disponible pour les patients de 2 ans et plus, pesant moins de 25 kg, porteurs d’une mutation gating1. Pour cette nouvelle indication, Kalydeco® est conditionné sous forme de granulés (en boîte de 56 sachets de 50 mg ou 75 mg) et sera délivré dans les pharmacies d’officine.
Les résultats de l’essai clinique (KIWI) réalisé chez les patients âgés de 2 à 5 ans atteints de mucoviscidose et porteurs d’une mutation gating1 avaient permis, en 2015, au laboratoire Vertex Pharmaceuticals d’obtenir une extension de l’autorisation de mise sur le marché (AMM) à cette jeune population.
La recherche se poursuit avec une évaluation de Kalydeco® sur le long terme et dans les conditions réelles d’utilisation (hors essai clinique).
Kalydeco® est le témoin d’une recherche contre la mucoviscidose en plein essor, qui s’oriente vers une médecine personnalisée et préventive à mettre en place dès le plus jeune âge pour tenter d’éviter l’apparition des symptômes précoces de la maladie.
À ce jour, selon les données 2015 du Registre français de la mucoviscidose, 124 patients sont sous traitement Kalydeco ®, et la nouvelle formulation permettra à une vingtaine d’enfants d’en bénéficier en France dès l’âge de deux ans.
L’histoire de Kalydeco ® en quelques dates :
• juillet 2012 : AMM pour les patients de 6 ans et plus porteurs de la mutation G551D ;
• juillet 2014 : extension de l’AMM pour des patients porteurs d’une mutation gating1 autre que G551D ;
• novembre 2015 : nouvelle extension de l’AMM pour les patients dès 2 ans porteurs d’une mutation gating1 et pour les patients de 18 ans et plus avec la mutation R117H.
1 Mutations gating : G551D, G1244E, G1349D, G178R, G551S, S1251N, S1255P, S549N ou S549R qui sont des mutations de défaut de régulation (classe III) du gène CFTR.
Crédits photo : ©Vertex Pharmaceuticals.